محتويات
بوربونيت درس نماذج الذرة علوم صف ثالث متوسط فصل ثاني عام 1445
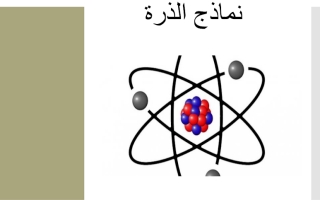
نموذج الذرة
النواة:
البروتونات (p):
- تمثلها نقاط ملونة باللون الأحمر.
- تحمل شحنة موجبة.
النيوترونات (n):
- تمثلها نقاط لا لون لها.
- لا تحمل شحنة كهربائية (محايدة).
المدارات الإلكترونية:
- الإلكترونات (e):
- تمثلها نقاط سوداء حول النواة.
- تحمل شحنة سالبة.
الطبقات الإلكترونية:
- يمكن رسم دوائر حول النواة لتمثيل المدارات الإلكترونية.
- يمكن توزيع الإلكترونات في طبقات حسب الطاقة.
الشحنة الكلية للذرة:
- النظام كله محايد إذا كان عدد البروتونات يساوي عدد الإلكترونات.
الرموز الكيميائية:
- تُستخدم الرموز لتمثيل العناصر، مثل "H" للهيدروجين.
الخصائص الكيميائية:
- تعتمد على توزيع الإلكترونات في المدارات وعلى عدد البروتونات في النواة.
المثال:
- لنأخذ عنصر الهيدروجين كمثال:
- يحتوي على نواة واحدة (بروتون واحد).
- إلكترون واحد يدور حول النواة.
الاستنتاج:
توضح هذه النماذج البسيطة الهيكل الأساسي للذرات وكيف يتكون الذرات من مكوناتها الأساسية. يمكن تعديل النموذج لشرح خصائص العناصر الأخرى.
مقالات ذات صلة
توضيح إضافي لنموذج الذرة
النواة:
البروتونات (p):
- تمثلها نقاط حمراء داخل النواة.
- لها شحنة موجبة.
النيوترونات (n):
- تمثلها نقاط بيضاء داخل النواة.
- لا تحمل شحنة كهربائية (محايدة).
المدارات الإلكترونية:
الإلكترونات (e):
- تمثلها نقاط سوداء حول النواة.
- لها شحنة سالبة.
المدارات الإلكترونية:
- يمكن رسم دوائر لتمثيل المدارات التي يدور فيها الإلكترون حول النواة.
الطبقات الإلكترونية:
- الطبقات:
- يمكن تمثيل الطبقات الإلكترونية بتوزيع دائري للإلكترونات حول النواة.
الشحنة الكلية للذرة:
- الشحنة:
- يتم الإشارة إلى أن مجموع شحنات البروتونات تعادل مجموع شحنات الإلكترونات، مما يجعل الذرة محايدة.
الرموز الكيميائية:
- الرموز:
- يُستخدم رمز العنصر الكيميائي لتمثيل الذرة، مثل "O" للأكسجين.
المثال:
- نموذج للأكسجين:
- نواة تحتوي على عدد من البروتونات والنيوترونات.
- إلكترونات تدور في مدارات حول النواة.
الاستخدامات التعليمية:
- التبسيط:
- يُستخدم هذا النموذج لتبسيط الهيكل الداخلي للذرة وتوضيح العلاقات بين مكوناتها.
الختام:
- التفاعلات الكيميائية:
- يمكن استخدام هذا النموذج لشرح كيفية حدوث التفاعلات الكيميائية بين العناصر